I - TÍNH CHẤT HÓA HỌC
1. Phản ứng thế H của nhóm OH ancol
a) Phản ứng chung của ancol
Thực nghiệm: Cho Na tác dụng với etanol dư (bình A không cần đun nóng), phản ứng xảy ra êm dịu (không mãnh liệt như với nước).
Chưng cất đuổi hết etanol dư, trong bình còn lại chất rắn là natri etylat:
C2H5OH+Na→1/2 H2+C2H5ONa
natri etylat
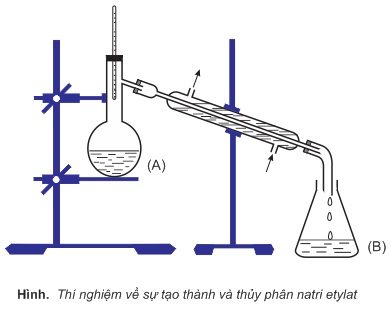
Cho nước vào bình A, chất rắn tan hết. Dung dịch thu được làm hồng phenolphtalein.
Chưng cất thì lại thu được etanol (ở bình B) và NaOH(ở bình A):
C2H5ONa+HOH→C2H5OH+NaOH
* Ancol tác dụng với kim loại kiềm tạo ra ancolat và giải phóng hiđro:
RO−H+Na→1/2 H2+RO−Na
natri ancolat
* Ancol hầu như không phản ứng được với NaOH, mà ngược lại, natri ancolat bị thủy phân hoàn toàn:
RO−Na+H−OH→RO−H+NaOH
b) Phản ứng riêng của glixerol
Glixerol hòa tan được Cu(OH)2 tạo thành phức chất tan, màu xanh da trời:
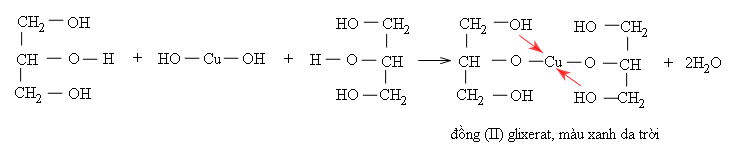
Phản ứng này được dùng để nhận biết glixerol và các poliancol mà các nhóm OH đính với những nguyên tử C cạnh nhau, chẳng hạn như etylen glicol.
2. Phản ứng thế nhóm OH ancol
a) Phản ứng với axit
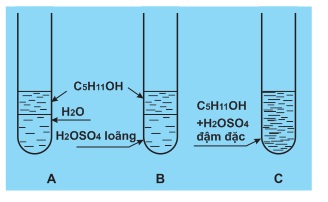
Kết quả thực nghiệm cho thấy:
(CH3)2CHCH2CH2OH (ancol isoamylic), hầu như không tan trong nước, không tác dụng với dung dịch axit loãng, lạnh nhưng tan trong H2SO4 đậm đặc.
(CH3)2CHCH2CH2−OH+H2SO4→(CH3)2CHCH2CH2−OSO3H+HOH
isoamyl hiđrosunfat (tan trong H2SO4)
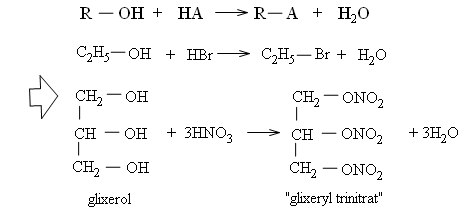
Nhận xét: Ancol tác dụng với các axit mạnh như axit sunfuric đậm đặc lạnh, axit nitric đậm đặc, axit halogenhiđric bốc khói . Nhóm OH ancol bị thế bởi gốc axit (A).
b) Phản ứng với ancol
Đun etanol với H2SO4 đặc ở 140oC, cứ 2 phân tử ancol tách 1 phân tử nước tạo thành 1 phân tử đietyl ete. (Thực chất đây là phản ứng thế nhóm OH bằng OC2H5).
C2H5O−H+HO−C2H5→(140oC H2SO4 đ) C2H5−O−C2H5+HOH
3. Phản ứng tách nước
Khi đun với H2SO4 đặc ở 170oC, cứ mỗi phân tử ancol tách 1 phân tử nước, tạo thành 1 phân tử anken.
Hướng của phản ứng tách nước nội phân tử tuân theo quy tắc Zai-xép:
Nhóm OH ưu tiên tách ra cùng với H ở nguyên tử C bậc cao hơn bên cạnh để tạo thành liên kết đôi C=C
Ví dụ:
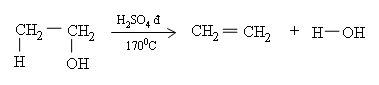
4. Phản ứng oxi hóa
* Ancol bậc I bị oxi hóa nhẹ thành anđehit
R−CH2−OH+CuO→to R−CH=O+Cu+H2O
anđehit
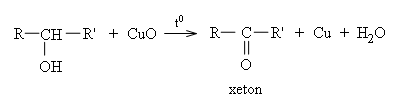
* Ancol bậc II bị oxi hóa nhẹ thành xeton.
* Ancol bậc III bị oxi hóa mạnh thì gãy mạch cacbon.
* Ancol cháy tạo thành CO2,H2O và tỏa nhiệt.
CnH2n+1OH+3n/2 O2−→to nCO2+(n+1)H2O
II - ĐIỀU CHẾ VÀ ỨNG DỤNG
1. Điều chế
a) Điều chế etanol trong công nghiệp
* Hiđrat hóa etilen xúc tác axit.
CH2=CH2+HOH→ (H2SO4,300oC) CH3CH2OH
* Lên men tinh bột
(C6H10O5)n+nH2O−→−−enzimnC6H12O6
tinh bột glucozơ
C6H12O6→enzim 2C2H5OH+2CO2↑
b) Điều chế metanol trong công nghiệp
Metanol được sản xuất từ metan theo hai cách sau:
CH4+H2O→to,xt CO+3H2
CO+2H2→ (400oC,200atmZnO,CrO3) CH3OH
2CH4+O2→ (200oC,100atm Cu) 2CH3−OH
2. Ứng dụng
a) Ứng dụng của etanol
Etanol là ancol được sử dụng nhiều nhất.
* Etanol được dùng làm nguyên liệu để sản xuất các hợp chất khác như đietyl ete, axit axetic, etyl axetat,...
* Một phần lớn etanol được dùng làm dung môi đẻ pha chế vecni, dược phẩm, nước hoa,...
* Etanol còn được dùng làm nhiên liệu: dùng cho đèn cồn trong phòng thí nghiệm, dùng thay xăng làm nhiên liệu cho động cơ đốt trong.
* Điều chế các loại rượu uống nói riêng hoặc các đồ uống có etanol nói chung, người ta chỉ dùng sản phẩm của quá trình lên men rượu các sản phẩm nông nghiệp như: gạo, ngô, sắn, lúa mạch, quả nho,... Trong một số trường hợp còn cần phải tinh tế loại bỏ các chất độc hại đối với cơ thể.Uống nhiều rượu rất có hại cho sức khỏe.
b) Ứng dụng của metanol
* Ứng dụng chính của metanol là để sản xuất anđehit fomic (bằng cách oxi hóa nhẹ) và axit axetic (bằng phản ứng với CO). Ngoài ra còn được dùng để tổng hợp các hóa chất khác như metylamin, metyl clorua,...
* Metanol là chất rất độc, chỉ cần một lượng nhỏ vào cơ thể cũng có thể gây mù lòa, lượng lớn hơn có thể gây tử vong.