I- ĐỒNG ĐẲNG VÀ DANH PHÁP
1. Dãy đồng đẳng và tên thông thường của anken
Etilen (C2H4), propilen (C3H6), butilen (C4H8),... đều có một liên kết đôi C=C, có công thức chung là CnH2n(n≥2). Chúng hợp thành dãy đồng đẳng gọi là dãy đồng đẳng của etilen.
Tên của một số anken đơn giản lấy từ tên của ankan tương ứng nhưng đổi đuôi an thành đuôi ilen. Thí dụ
CH2=CH−CH3 CH2=CH−CH2−CH3 CH3−CH=CH−CH3
propilen α−butilen β−butilen
Nhóm CH2=CH− được gọi là nhóm vinyl.
2. Tên thay thế
a) Quy tắc
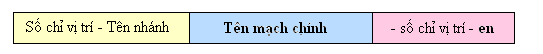
Mạch chính là mạch chứa liên kết đôi, dài nhất và có nhiều nhánh nhất.
Đánh số C mạch chính bắt đầu từ phía gần liên kết đôi hơn.
Số chỉ vị trí liên kết đôi ghi ngay trước đuôi en (khi mạch chính chỉ có 2 hoặc 3 nguyên tử C thì không cần ghi).
b) Thí dụ
CH2=CH2;CH2=CH−CH3;CH2=CH−CH2−CH3;CH3−CH=CH−CH3
etenpropenbut−1−enbut−2−en
II - CẤU TRÚC VÀ ĐỒNG PHÂN
1. Cấu trúc
Hai nguyên tử C mang nối đôi ở trạng thái lai hoá sp2 (lai hoá tam giác).
Liên kết đôi C=C ở phân tử anken gồm một liên kết σ và một liên kết π. Liên kết σ được tạo thành do sự xen phủ trục (của hai obitan lai hoá sp2) nên tương đối bền vững. Liên kết π được tạo thành do sự xen phủ bên (của 2 obitan lai hoá p) nên kém bền hơn so với liên kết σ. Hai nhóm nguyên tử liên kết với nhau bởi liên kết đôi C=C không quay tự do được xung quanh trục liên kết (do bị cản trở bởi liên kết π)
Ở phân tử etilen, hai nguyên tử C và bốn nguyên tử H đều nằm cùng trên một mặt phẳng (gọi là mặt phẳng phân tử), các góc HCHˆ và HCCˆ hầu như bằng nhau và gần bằng 120o.
2. Đồng phân
a) Đồng phân cấu tạo
Anken từ C4 trở lên có đồng phân mạch cacbon và đồng phân vị trí liên kết đôi.
Thí dụ: CH2=CHCH2CH2CH3 CH3CH=CHCH2CH3
pent−1−en pent−2−en
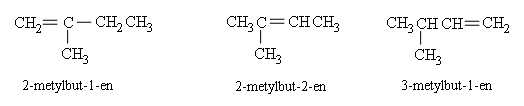
b) Đồng phân hình học
Anken từ C4 trở lên nếu mỗi C mang liên kết đôi đính với 2 nhóm nguyên tử khác nhau thì sẽ có 2 cách phân bố không gian khác nhau dẫn tới 2 đồng phân hình học. Nếu mạch chính nằm cùng một phía của liên kết C=C thì gọi là đồng phân cis. Nếu mạch chính nằm ở hai phía khác nhau của liên kết C=C thì gọi là đồng phân trans.
Thí dụ:
.jpg)