I - NHÓM HALOGEN TRONG BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ
Nhóm VIIA trong bảng tuần hoàn gồm 5 nguyên tố: Flo (ô số 9, thuộc chu kì 2), clo (ô số 17, thuộc chu kì 3), brom (ô số 35, thuộc chu kì 4), iot (ô số 53, thuộc chu kì 5) và atatin (ô số 85, thuộc chu kì 6).
Cả 5 nguyên tố trên đều đứng ở cuối chu kì, ngay trước khí hiếm. Chúng được gọi là các halogen (tiếng Latinh nghĩa là sinh ra muối).
Atatin không gặp trong thiên nhiên. Nó được điều chế nhân tạo bằng các phản ứng hạt nhân. Atatin được nghiên cứu trong nhóm các nguyên tố phóng xạ.
Như vậy nhóm halogen được nghiên cứu ở đây bao gồm flo, clo, brom và iot.
II - CẤU HÌNH ELECTRON NGUYÊN TỬ VÀ CẤU TẠO PHÂN TỬ CỦA CÁC NGUYÊN TỐ TRONG NHÓM HALOGEN
Lớp electron ngoài cùng của nguyên tử các halogen có 7 electron: 2 electron trên obitan s và 5 electron trên các obitan p. Như vậy, cấu hình electron lớp ngoài cùng của nguyên tử các halogen là ns2np5(n là số thứ tự của lớp ngoài cùng).
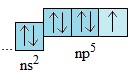
Từ flo đến iot, số lớp electron tăng dần và electron lớp ngoài cùng càng xa hạt nhân hơn.
Ở trang thái cơ bản, nguyên tử các halogen đều có một electron độc thân.
Lớp electron ngoài cùng của nguyên tử flo là lớp thứ hai nên không có phân lớp d. Nguyên tử clo, brom và iot có phân lớp d còn trống, khi được kích thích, 1,2 hoặc 3 electron có thể chuyển đến những obitan d còn trống:
Electron lớp ngoài cùng ở trạng thái cơ bản Electron lớp ngoài cùng ở trạng thái kích thích
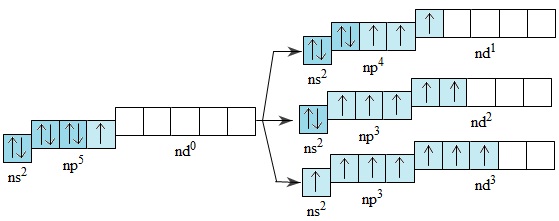
Như vậy, ở các trạng thái kích thích, nguyên tử clo, brom hoặc iot có thể có 3,5 hoặc 7 electron độc thân. Điều này góp phần giải thích khả năng tồn tại các trạng thái oxi hóa của clo, brom, iot.
Đơn chất halogen không phải là những nguyên tử riêng rẽ mà là những phân tử:
Hai nguyên tử halogen X kết hợp với nhau bằng liên kết cộng hóa trị tạo thành phân tử X2:
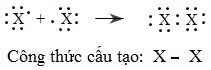
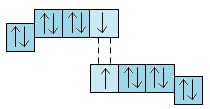
Năng lượng liên kết X−X của phân tử X2 không lớn (từ 151 đến 243kJ/mol), nên các phân tử halogen tương đối dễ tách thành hai nguyên tử.
III - KHÁI QUÁT VỀ TÍNH CHẤT CỦA CÁC HALOGEN
1. Tính chất vật lí
Trong nhóm halogen, các tính chất vật lí như: Trạng thái tập hợp, màu sắc, nhiệt độ nóng chảy, nhiệt độ sôi...biến đổi có quy luật.
Bảng 5.1
Một số đặc điểm của các halogen
Flo không tan trong nước vì nó phân hủy nước rất mạnh. Các halogen khác tan tương đối ít trong nước và tan nhiều trong một số dung môi hữu cơ.
2.Tính chất hóa học
Vì lớp electron ngoài cùng có cấu hình tương tự nhau nên các halogen có nhiều điểm giống nhau về tính chất hóa học của đơn chất cũng như về thành phần và tính chất của các hợp chất.
Nguyên tử halogen X với 7 electron lớp ngoài cùng dễ dàng thu thêm 1 electron để tạo thành ion âm X− có cấu hình electron của khí hiếm liền kề trong bảng tuần hoàn:
X + 1e → X−
...ns2np5 ...ns2np6
Các halogen có độ âm điện lớn. Độ âm điện của flo (bằng 3,98) là lớn nhất trong tất cả các nguyên tố hóa học. Từ flo đến clo, brom và iot, bán kính nguyên tử tăng dần và độ âm điện giảm dần.
Halogen là những phi kim điển hình, chúng là những chất oxi hóa mạnh. Khả năng oxi hóa của các halogen giảm dần từ flo đến iot.
Trong các hợp chất, flo luôn luôn có số oxi hóa −1, các halogen khác ngoài số oxi hóa −1 còn có các số oxi hóa +1,+3,+5,+7.
Những điều khái quát kể trên sẽ được thấy rõ ràng và cụ thể hơn qua các bài học về từng nguyên tố halogen.